Dělal disertaci u legendárního profesora Holého. Když vypráví o chemických reakcích, hydroxymethylových skupinách, plazmidech nebo DNA, mluví poutavě, jako by enzymy ze zkumavek žily a měly svůj příběh.
Profesor Ing. Michal Hocek, CSc. DSc. pracuje na něčem, co se jednou, možná, bude jmenovat jako „ovladač na geny“. .
Přesněji přepínač DNA. Českým vědcům z Ústavu organické chemie a biochemie Akademie věd ČR a Univerzity Karlovy se letos podařilo objevit umělý chemický přepínač DNA citlivý na světlo. Tím udělali první krok na cestě k umělé epigenetice – cílenému zapínání a vypínání genů.
Jednou možná bude možnost pomocí světla gen vypnout a zapnout. Aktivovat a deaktivovat. Je to vize vzdálené budoucnosti, nicméně šance tu je. „Zatím jsme pracovali jen ve zkumavce na neživých biomolekulách“ říká v druhém rozhovoru pro časopis 21. STOLETÍ Prof. Ing. Michal Hocek, CSc. DSc.
Rozhovor č. 2
Prof. Ing. Michal Hocek, CSc. DSc.
český vědec působící na Ústavu organické chemie a biochemie Akademie věd ČR a profesor organické chemie na Univerzitě Karlově v Praze, který se specializuje na chemii a chemickou biologii nukleosidů, nukleotidů a nukleových kyselin.
Prof. Hocek je autorem více než 250 vědeckých publikací a několika patentů. Jeho práce byly citovány 6600krát a dosáhl h-indexu 44 (Hirschův index je jeden z indexů citačního ohlasu vědeckých článků, publikovaných jedním vědeckým pracovníkem).
Aktuálně vede tým 26 kolegů z 11 států s polovičním podílem žen.
Výzkum jste prováděli zatím jen ve zkumavce s bakteriálními enzymy. Pracovat s bakteriemi začnete kdy?
Teď… Ale ono to má spoustu úskalí, které musíme překonat. Technicky. Když bakterii dodáme modifikovanou DNA, tak ona má svoje DNA polymerázy, které začnou dodanou DNA replikovat. Množit.
A to nechcete…
To už by modifikovaná DNA nebyla, protože bakterie použije na replikaci přirozené stavební kameny. Máme jen velmi malý okamžik, kdy můžeme oddělit efekt naší modifikace od repliky. Musíme se pokusit replikaci pro tu danou dobu vypnout, abychom viděli, že experiment je kvůli naší modifikaci a ne samovolným množením.
Jak to vyřešit?
Bakteriální enzymy si můžeme přenést do eukaryotické buňky. Plazmid (malá kruhová molekula DNA schopná transkripce, která se přirozeně vyskytuje v cytoplazmě některých bakterií, pozn. red.), který je kóduje, se tam už nebude replikovat.
Když tam nějaký efekt budeme pozorovat, tak víme, že je to kvůli té modifikaci. V živém organismu je to mnohem složitější.
Teď k samotnému výzkumu přepínače genů… Už Einstein říkal, že „látce rozumíte bezpečně teprve tehdy, když jste schopný ji vysvětlit vlastní babičce.“ Dá se to vysvětlit jednoduše?
Princip je v tom aktivovat zamaskované geny pomocí nějakého impulzu, např. světla. Zatím se zabýváme chemickými principy a jsme pouze ve stadiu zkumavky. Ale je to umělá chemická analogie toho, co se v buňce děje.
Buňka reguluje expresi genů pomocí enzymů, které methylují nebo demethylují DNA. Je to poměrně složitá mašinérie proteinů.
Ví se o tom sice už poměrné hodně, ale úplně do detailu se tomu nerozumí. Studujeme to teď z pohledu chemie, ne biologie.
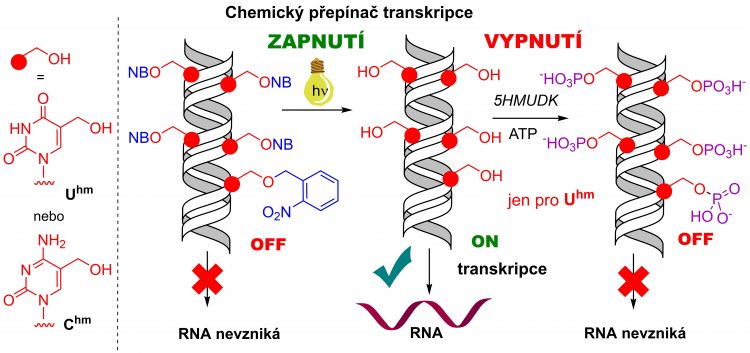
Člověk má nějakých 20-25 tisíc aktivních genů a dalších 20 000 neaktivních. Jak přesně vypínáte transkripci enzymatické fosforylace hydroxymetylových skupin?
První krok byl, že jsme schopni syntetizovat maskovanou DNA obsahující fotolabilní modifikace, u které je transkripce vypnuta, a zapnout transkripci po ozáření viditelným světlem, kdy fotolabilní modifikace odpadnou.
K tomuto výzkumu jsme přistoupili tak, že nás nezajímalo, jestli je to biologicky relevantní nebo ne. Šlo nám o to, jestli je to možné. Ale jak jsme studovali vliv různých modifikací, tak jsme zjistili, že některé modifikace na DNA jsou vlastně lepší, než jak je přirozená DNA. Díky výzkumu jsme objevili i modifikace, které dokázaly „superzapnout“ gen.
Třeba na nějakých 350 procent ve srovnání s běžnou DNA. Právě některé tyhle modifikace se v přírodě vyskytují, ale jsou velmi vzácné, je to takzvaný hydroxylmethyluracil a hydroxymethylcytosin. Ty se velmi vzácně vyskytují i v lidském genomu a jejich funkce ještě není plně objasněna.
Ale kromě toho se vyskytují v takzvaném bakteriofágu, což je virus, která napadá bakterie. A on jich má ve své DNA hodně. My zřejmě mimoděk přišli na to, k čemu tomu viru ty modifikace jsou. Zdá se, že virus infikuje bakterii a ta jeho DNA se přepisuje efektivněji než ta bakteriální. Získává výhodu.
Translaci, kterých konkrétních proteinů lze takto ovlivnit, aby se dalo říct, že se epigeneticky ovlivní proteiny spojené s konkrétními nemocemi?
V principu jakýchkoli. Virový genom obsahuje spoustu hydroxymetylových skupin.
Umíte chemicky DNA uměle zamaskovat. Skrýt ji, aby byla neaktivní, a potom takto vypnutý gen zase zapnout. Klíčovou roli v tom hraje světlo o vlnové délce 400 nm, proč?
Snažíme se používat světlo s co nejvyšší vlnovou délkou. Čím vyšší je, tím méně toxické je pro živé organismy a tím hlouběji by pronikalo do tkání, kdybychom se dostali k experimentům na živých organismech.
Když je použito ultrafialové světlo 250-350 nm, tak pak dochází k významnému poškození DNA. Od 400 nm začíná viditelné světlo, takže 400 nm je hranice. Tohle světlo už je pro buňky málo toxické. V budoucnu se pokusíme aplikovat i červené světlo, které proniká do tkáně až na několik milimetrů.
Co bude následovat za rok dva tři?
Chceme to posunout do živých organismů a najít si konkrétní aplikace, kde by se to dalo prakticky využít. Umíme si představit případ, kdy v jeden konkrétní moment spustit expresi nějakého konkrétního genu.
Že prostě buňka do nějakého okamžiku nebude produkovat protein, a od nějakého přesně daného okamžiku už ano. A pak to zase třeba vypnout. Mít nad konkrétním genem moc ho zapnout a vypnout.

A konkrétně v praxi v běžném životě?
Zatím nechci spekulovat o nějaké terapeutické praxi, i když v nějakém velmi dlouhém horizontu bychom se i o tom mohli bavit.
Už se dotýkáme epigenetiky (podobor genetiky, jenž studuje změny v genové expresi). Jak se geny mění? Mohou se měnit i na základě prodělaných traumat snad v důsledků krácení telomer? Výzkumy na to už jsou….
Tohle je v posledních letech předmětem velmi intenzivního výzkumu. Ukazuje se, že vliv stresu a dalších různých externích faktorů na epigenetiku (zapínání a vypínání genů) je poměrně výrazný. Je to ale ještě daleko, abychom tomu plně rozuměli.
Třeba ve studiích na dvojčatech, žijících odděleně v jiném prostředí, se ukazuje, že jejich epigenetika se výrazně liší. Zároveň to poměrně dobře vysvětluje, že nejen genetická predispozice, ale i vliv toho, jak se člověk stravuje, jak zdravě žije, má významný efekt na vzniku některých onemocnění, např. rakoviny.
Vliv na to se nedá zpochybnit, ale pochopit detailní mechanismy, si myslím, bude ještě desetiletí trvat.
Sám jste řekl, že „Výsledky zatím přinášejí mnohem více otázek než odpovědí, ale otevírají několik nových zajímavých směrů výzkumu…“ Jaké? Co bude následovat?
Zrovna v tomto projektu, čím více získáváme výsledků, tak se objevuje řada velmi nečekaných a zajímavých věcí, které vyvolávají další úroveň otázek, které jsme si před tím nekladli, protože nás nenapadly.
Až při analýze jsme si říkali, že by to mohlo být zajímavější, než jsme doufali.
Třeba?
Nevědělo se, že by mohlo být možné modifikací DNA zvýšit transkripci. To je zásadní posun paradigmatu. Význam těchto poznatků bude zřejmě důležitý hlavně v biologii, přestože my to bereme zatím spíše z chemického pohledu.
Překonat příkop mezi chemií a biologií je obtížné. Tady bych zdůraznil, že je pro nás naprosto klíčová spolupráce se skupinou molekulárních biologů pod vedením doktora Krásného z Mikrobiologického ústavu. Bez nich bychom na této tematice nebyli nikdy schopni dělat.
Jsme v budově Ústavu organické chemie a biochemie, kde pracoval desítky let i profesor Holý. I díky jeho patentům a licencím získal ÚOCHB nějakých desítky miliard korun.
Ano, pohybuje se to celkově v řádu mnoha miliard. To nám samozřejmě umožnilo postavit tuto budovu a vybavit ji perfektními přístroji. Nakoupili jsme nejmodernější přístroje a můžeme investovat do rozvoje nových juniorských skupin.
Kolik jich máte?
Aktuálně 12, což jsou nově založené skupiny kolem jednoho mladého vědce (nebo vědkyně), který se vrátil z dlouhodobějšího zahraničního pobytu, který má svůj vlastní nápad, chce si ho rozvíjet, a zvítězil v mezinárodním konkurzu.
Zrovna teď ústav inzeruje další pozici v organické chemii. Může se na to přihlásit kdokoli z celého světa. Samozřejmě se posuzuje to, co udělali, čím prošli a samotný nápad, jak je převratný, jak je riskantní.
A riskujete hodně?
Požaduje se, aby kandidáti přišli s něčím úplně novým, převratným, klidně i velmi riskantním.
A ústav ho pak podpoří…
Dá mu velmi velkorysý startovací balíček, vybavenou laboratoř, peníze na několik spolupracovníků a materiály. Během pěti let se musí ukázat, jestli jeho myšlenka byla skutečně dobrá. Jestli si to dokáže obhájit.
Po pěti letech je poměrně přísné mezinárodní hodnocení. Buď pak na ústavu zůstane, nebo bude muset odejít. Ale i kdyby nezůstal, tak si rozvinul nějakou vlastní tématiku a může přejít na jinou instituci v Česku nebo kamkoli jinam. ÚOCHB tedy působí jako inkubátor nových skupin a nápadů.
Jak velký je ten startovací balíček?
Každý vedoucí té nové skupiny si to dohaduje s ředitelem. Záleží i na typu výzkumu, Některé jsou dražší. Musí se koupit nákladný přístroj, který stojí třeba 20 milionů. Pokud ho k vědě nutně potřebuje a přesvědčí ředitele, tak mu to ústav koupí.
Ale provozní peníze se pohybují kolem 10-15 milionů. Ale předpokládá, že to je opravdu jen startovací balíček, takový základ, že si vedoucí skupiny za těch pět let seženou sami vlastní granty. Existuje spousta soutěží jen pro juniorské vědce a skupiny, u domácích agentur i u Evropské výzkumné rady.
Člověk by neřekl, že to takhle funguje.
Ale ono to funguje na dobrých výzkumných institucích na západě. U nás tento model nastartoval předchozí ředitel Zdeněk Havlas (vedl Ústav organické chemie a biochemie AV ČR v letech 2002–2012), dnes je místopředseda Akademie věd, který systém spustil, a dnes to pokračuje pod současným ředitelem Zdeňkem Hostomským.
I seniorské skupiny, jako je ta moje, jsou jednou za 5 let velmi přísně hodnoceny mezinárodním poradním sborem. Musíme ukázat významný pokrok oproti předchozímu, abychom si svoji existenci obhájili. Kdybych dvakrát po sobě nedostal lepší než průměrné hodnocení (ve srovnání se světem), tak by moje skupina byla postupně rozpuštěna.
Je to poměrně přísný ale velmi motivační systém, který nás nutí, abychom pracovali tvrdě a zároveň se pouštěli do nových a riskantních věcí.
Zatímco, kdybyste dělali průměrnou vědu…
… Tak ta by před mezinárodním poradním sborem neobstála. Pouštíme se do několika nových projektů. Některé třeba neobstojí, některé ano, ale musíme se snažit o koncepčně nové věci, které budou významně posunovat hranice poznání a budou publikované ve špičkových vědeckých časopisech, případně i patentovatelné a využitelné i v praxi.
Taková absolutoria po pětiletce.
Ano, ale bohužel takovýto přísný a vysoce motivační systém zatím funguje kromě našeho ústavu jen na několika málo dalších institucích, zatímco jinde se hodnocení provádí spíše formálně nebo vůbec. Velku nadějí do budoucna je ale nová Metodika hodnoceni výzkumu, která se postupně spouští a měla by nejen globálně hodnotit celé velké university a instituce, ale zároveň je i motivovat, aby si pravidelně prováděli vlastní interní hodnocení, které bude detailně evaluovat jednotlivé výzkumné skupiny (podobně jako nyní na našem ústavu).
Jan Zelenka
Box
Zbraně na nádory
Ve skupině Michala Hocka mají dvě velká témata. Pracují na velkých molekulách, na modifikacích nukleových kyselin (DNA a RNA) a pak také na modifikacích stavebních bloků nukleosidů a nukleotidů. Prvním tématem je medicinální chemie, zejména vývoj protinádorových látek, zatímco v druhé oblasti jsou modifikované stavební bloky studovány jako substráty pro polymerázy a jsou tedy využitelné pro syntézu modifikované DNA nebo RNA s řadou potenciálních aplikací v bioanalýze nebo chemické biologii.
Jednou z těch aplikací je výše diskutovaný přepínač genů. „Těch aplikací ale máme mnohem víc, např. v zobrazování DNA pomocí fluorescenčních značek, konstrukce elektrochemických senzorů na detekci určité sekvence DNA, nebo takové reaktivní molekulové pastičky, které dokážou chytit a navázat bílkovinu, která interaguje s danou DNA,“ říká profesor Hocek.
Z první oblasti výzkumu mají několik zajímavých protinádorových nukleosidů, u kterých zjistili poměrně unikátní mechanismus účinku spočívající v nitrobuněčné aktivaci, zabudování do DNA a tvorbu dvouřetězcových zlomů, které vedou k buněčné sebevraždě (apoptóze).
Tento mechanismus je odlišný od doposud známých cytostatických nukleosidů, které většinou zablokují nějaký klíčový enzym v biosyntéze nukleových kyselin.
„V tuto chvíli máme několik velmi zajímavých sloučenin, které jsme patentovali, které umí selektivně zahubit nádorové buňky. Jsme v preklinických testech, studujeme jejich toxicitu, detailní mechanismus účinku, všechny možné vlastnosti, a pokud by vše šlo dobře, tak během několika let bychom mohli mít látku, která by mohla být kandidátem na klinické studie s pacienty.“ Ale to je ještě hodně daleko. Několik let.