V roce 2000 oznámili vědci světu, že přečetli kompletní lidskou dědičnou informaci. O rok později byly výsledky jejich práce zveřejněny, a tak se zdá, že už víme, co z nás dělá člověka, co nás činí náchylnými k chorobám či co nám propůjčuje talent. 
K tak důkladnému pochopení lidského genomu nám však ještě hodně chybí. A to hned z několika důvodů. Stále jsme ještě neobjevili úplně všechny geny a u většiny z nich zatím netušíme, k čemu nám jsou dobré a co se stane, když nepracují tak, jak mají.
V neposlední řadě se celkem překvapivě ukázalo, že samotný zápis písmeny genetického kódu v molekule DNA zdaleka ještě neobsahuje veškerou dědičnou informaci. S již notoricky známým slovem „genom“ tak dnes vědci jedním dechem skloňují i novinku ve svém žargonu, „epigenom“ a „epigenetická informace“.
Genetická symfonie
Genom, tedy dědičnou informaci zakletou do dvojité šroubovice DNA písmeny genetického kódu, si můžeme představit jako noty. Jednotlivé geny by pak vystupovaly v roli zápisu různých skladeb. Je to velmi různorodá „hitparáda“.
Některé geny se od sebe liší asi jako Bachova fuga od posledního šlágru Madonny. Jiné geny jsou si podobné jako nekonečné zástupy starých evergreenů. Mnohé geny se sice liší, ale na druhé straně sdílejí společné motivy.
Vzniká tak obdobná situace, jako když ve Smetanově Vltavě narazíme na melodii, nápadně podobnou lidové písni „Kočka leze dírou…“.
Člověk nemusí být hudební znalec, aby pochopil, že samotné noty k určení celkového vyznění skladby nestačí. Skladatel je musí „obalit“ dalšími pokyny. Určuje například, zda mají tóny znít rychle po sobě nebo pomalu, zda se má skladba hřímat „forte“ nebo ševelit „piano“. V některých místech předepisuje změnu hlasitosti, jinde zase změnu tempa.
Také „symfonie dědičnosti“ v našich buňkách si nese podobná „znaménka“. I geny mohou pracovat ve velkém kalupu nebo naopak téměř umlknout. V roli znamének tu vystupují molekuly, které se vážou na DNA. Jsou přichyceny na jejím povrchu jako tu více a tu zase méně kompaktní obal. Často mohou zcela změnit výsledné „vyznění“ genu.
Záleží na obalu
Představme si nyní, že je v dědičné informaci písmeny genetického kódu napsáno poselství „DOKOŘÁN OTEVŘOU“. Epigenetický obal nám může nechat z textu „čitelné“ jen některé části (my si je znázorníme tučnými písmeny). V prvním případě se text mění na „DOKOŘÁN OTEVŘOU“ a z původní zprávy se vytvoří slovo „DŘEVO“. V druhém případě jsou čitelná jiná písmena „DOKOŘÁN OTEVŘOU“ a z textu se nám vynoří slovo „KOV“.
Za konkrétním příkladem zcela odlišného čtení jedné a téže různě „obalené“ dědičné informace se nyní vydáme k myším a jejich genu označovanému jako „aguti“. Pokud je tento gen „obalen“ jen málo, čte jej organismus jako pokyn pro růst rezavé srsti, tloustnutí a silné náchylnosti k nádorovému bujení. Pokud je úsek DNA s genem „aguti“ obalen silněji, pak jej organismus čte jako instrukci k růstu hnědočerné srsti, štíhlé postavy a odolnosti k rakovině. Už z tohoto příkladu vysvítá, že „obaly“ genů jsou přinejmenším stejně důležité jako geny samotné a mohou rozhodovat o životně důležitých věcech.
Dva metry DNA v každé buňce
Epigenetické změny, tedy „obaly“ jednotlivých genů, vysvětlují i některé záhady. Jednou z nich jsou rozdíly v dědičných vlastnostech u jednovaječných dvojčat. Tito sourozenci mají úplně totožnou dědičnou informaci, a přesto se mohou lišit dědičným sklonem k rakovině, duševním chorobám a dalším neduhům. Jak to?
S „totožnou“ DNA jednovaječných dvojčat se to má jako s pohádkovou chytrou horákyní, jež byla bosa i obuta, učesaná i rozcuchaná a dokonce nahá i oblečená. DNA dvojčat je stejná i odlišná zároveň, totožné je pořadí písmen genetického kódu v dvojité šroubovici DNA. To rozhodně není málo. V každé buňce totiž máme asi dva metry DNA, jež se skládá z tří miliard písmen genetického kódu. Dvojčata se však mohou lišit v tom, jak, nakolik a kde je jejich dědičná informace obalená. A skutečně se liší. S postupujícím věkem se dokonce liší čím dál tím víc.
Proč jsou jednovaječná dvojčata různá?
Dokázal to velmi přesvědčivě španělský genetik Manel Esteller z Národního centra pro výzkum rakoviny v Madridu. Spolu se svými spolupracovníky prověřil dědičnou informaci osmdesáti párů jednovaječných dvojčat ve věku od tří do čtyřiasedmdesáti roků.
V útlém dětství mají dvojčata DNA obalenu prakticky totožně. V padesáti se však už odlišují v obalení třikrát většího počtu genů než ve věku tří let. A různě „obalené“ geny podávají i různý pracovní výkon, což může poslat dvojčata na zcela odlišné životní dráhy, rozhodovat o zdraví či nemoci, o životě a smrti.
„Nejsme jen to, co máme napsáno v genech,“ říká Esteller. „Není důležité jen pořadí písmen genetického kódu v DNA, ale také to jak aktivní jsou jednotlivé geny. Vysvětluje to také, proč mohou být jednovaječná dvojčata různě vnímavá k některým chorobám.“
Zabalený, či rozbalený?
Změny v obalování genů a s tím související změny v aktivitě genů nepostihují jen dvojčata. Odehrávají se v DNA každého z nás. Dnes a denně se nám některé části DNA „zahalují“ a jiné zase „rozkrývají“. Zatímco pořadí písmen vlastní dědičné informace nemůžeme změnit, „balení“ genů zřejmě máme do určité míry pod kontrolou. Názorně to dokládá opět příklad na myších s různě zabaleným genem „aguti“.
Matka s rozbaleným genem má rezatý kožíšek, je silně obézní a od útlého věku ji ohrožuje nádorové bujení. Za normálních okolností zdědí její potomci rozbalený „rezavý“ gen se vším, co k tomu patří. Pokud je ale matka během březosti krmena zvláštní dietou bohatou na látky schopné obalit DNA, může se jí narodit mládě se zabaleným genem. Takový potomek pak vypadá, jako kdyby ke své mámě ani nepatřil. Pod hnědočerným kožíškem se skrývá štíhlé tělo, kterému nehrozí zvýšené riziko rakoviny.
Není to na celý život
Pokud pustíme fantazii z uzdy a dovolíme si vyjít z pokusů na myši do všedního lidského života, pak musíme připustit, že někteří lidé přicházejí na svět s vrozenou dispozicí k některým chorobám ne proto, že by to měli vepsáno písmeny genetického kódu do DNA, ale proto, že jim jejich matka nevhodnou životosprávou během těhotenství pozměnila obaly důležitých genů.
Jak dokázala Estellerova studie na dvojčatech, aktivita našich genů není při narození určena jednou provždy! Pracovní tempo genů se nám mění pod diktátem vlivů z vnějšího prostředí po celý život. Geny se nám v těle probouzejí a nebo usínají podle toho, co jíme, jak moc jsme fyzicky aktivní, jestli kouříme, konzumujeme alkohol nebo se pohybujeme v prostředí s toxickými látkami.
Projíme se k dobrým genům?
Od tohoto zjištění je jen malý kousek k představě řízeného ovlivňování funkcí lidského genomu. Začalo by to už dietou nastávající matky, která by tak zajistila svému potomkovi start do života s náležitě pozapínanými geny.
Pokusy na laboratorních potkanech například prokázaly, že některé látky v potravě březích samic potlačují funkci genů, brzdících množení neuronů v mozku vyvíjejícího se plodu. Mláďata takto krmených matek se rodila s dokonaleji vyvinutým mozkem a dosahovala lepších výsledků při testech výkonnosti nervového systému. Zjednodušeně řečeno, mláďata byla o poznání chytřejší než mláďata matek krmených běžným krmivem.
Následně by dítě vedlo život podle receptu sepsaného na základě jeho genetických dispozic. Ty by zdaleka nezahrnovaly jen určení variant vybraných genů, ale také stav epigenetického „obalení“ jednotlivých částí jeho DNA. Vypadá to, že bychom se jednou mohli doslova „projíst“ k lépe fungujícím genům. Svítá nám tak naděje na delší a zdravější život.
Kde začít?
Vědci odhadují, že se na vzniku většiny závažných onemocnění až ze 70 % podílejí nedědičné vlivy. Z valné části to mohou být vlivy životních podmínek, jež sice ponechávají beze změny vlastní pořadí písmen genetického kódu, ale mění epigenetickou regulaci dědičné informace.
Pokud jsou tyto vize vůbec uskutečnitelné, povede k jejich realizaci trnitá cesta. Znamená to poznat nejprve velmi důkladně funkce „obalu“ lidské DNA. Genom je stejný ve všech buňkách těla, epigenom závisí na konkrétním typu buňky, proto se neustále mění. Jeho luštění je tedy střelbou na pohyblivý cíl.
Zatím se vědci shodují v tom, že jako první by měli prozkoumat epigenetické změny dědičné informace bílých krvinek zdravého člověka. Spolu s nimi ale chtějí zkoumat epigenetické změny v dědičné informaci dalších osmi či deseti typů buněk lidského těla. Potom by teprve mohly přijít na řadu první testy epigenetických změn, typických pro některé choroby, snad cukrovky či rakoviny.
DNA sbalená na „cívce“
Epigenomické změny dědičné informace – zjednodušeně řečeno „balení DNA“, jež mění aktivitu genů – spočívají ve dvou různých procesech.
V prvním jsou využívány jako „obalový materiál“ molekuly, které se napojují přímo na dvojitou šroubovici DNA. Obalení DNA určuje, jak a zda vůbec se mohou na dvojitou šroubovici vázat bílkoviny uvádějící geny do plného provozu.
Ve druhém případě jsou modifikovány molekuly, na kterých je DNA uložena. Dvojitá šroubovice DNA dosahuje v každé ze sta bilionů buněk lidského těla délky dvou metrů a je zřejmé, že musí být velmi pečlivě sbalena, aby se tam vůbec vešla. K balení DNA využívají buňky molekulární „cívky“ v podobě bílkovin zvaných histony, na něž může být dvojitá šroubovice namotána velmi těsně. Ve stísněných podmínkách „utažené“ DNA nemají geny a jejich „startovací“ bílkoviny dost místa a nemohou pracovat. Smyčky DNA ale mohou na histonech naopak povolit a v tom případě se geny uvádějí do chodu a začnou se podle nich v buňce vyrábět příslušné bílkoviny.
Každý histon je vybaven jakýmsi ocáskem, na který se může navázat více než 20 molekul. Ty se mohou na histonu kombinovat jako přívěsky na náhrdelníku. Některé přívěsky nebo jejich kombinace uvolňují smyčky DNA kolem histonové cívky, jiné je naopak utahují. Odborníci proto hovoří o molekulárních přívěscích navěšených na histonech jako o tzv. histonovém kódu.
Nový genetický obor
Nově se rozvíjející obor zvaný nutrigenetika kombinuje molekulární genetiku s vědou o zdravé výživě. Ve svém principu nejde přitom o nijak převratnou myšlenku. To, že by měl člověk zohlednit při stravování své dědičné dispozice, si víceméně uvědomuje každý. Nutrigenetika je prostě záležitostí všedního dne. Dokazují to případy lidí s dědičným sklonem k obezitě, kteří si hlídají množství energie spořádané v jídle a snaží se tak zahnat hrozbu nadváhy.
Ve své klasické podobě zahrnuje nutrigenetika nejprve vstupní genetické testy odhalující, jaké varianty vybraných genů konkrétní člověk zdědil. Na základě výsledků pak dostane program pro úpravy jídelníčku a životního stylu, jež jsou šité na míru jeho dědičným dispozicím.
K prověřovaným úsekům dědičné informace patří například geny, podle kterých se tvoří enzymy důležité pro metabolismus kyseliny listové. Majitelé některých variant těchto genů jsou zvýšeně citliví k nedostatku cholinu (živiny ze skupiny B vitamínů) v potravě a měli by si proto vybírat jídelníček, který jim zajistí dostatek tohoto vitaminu.
Paradoxy výživy
Některé varianty genu pro tvorbu enzymu myeloperoxidázy chrání ženy před nádorovým onemocněním prsu. Tato genetická dispozice se ale prosadí jen v případě, že žena konzumuje dostatečné množství ovoce a zeleniny.
Geneticky je podmíněn také metabolismus tuků a z toho vyplývající koncentrace „dobrého“ a „špatného“ cholesterolu v krvi. Lidé s některými variantami genu pro jaterní lipázu (enzym štěpící tuky na glycerin a mastné kyseliny) jsou po konzumaci tuků zvláště náchylní ke dramatickému zvýšení „špatného“ cholesterolu a měli by si na to dávat pozor. To je však opět možné jen v případě, že o své dědičné dispozici vědí.
Rozličné dědičné založení také vysvětluje paradoxy, s nimiž se každý z nás už určitě ve svém okolí setkal. Někdo drží relativně přísnou dietu a nedaří se mu normalizovat hladiny cholesterolu v krvi. A někomu se to daří, i když zásadami zdravé výživy celkem okázale pohrdá. V lékařské literatuře je popsán případ pětasedmdesátiletého muže, který konzumoval denně pětadvacet slepičích vajec a měl hladinu cholesterolu v normě. Většina z nás by si neměla dopřát více než dvě vejce týdně.
Jídelníček na míru?
Především v USA už vznikly nutrigenetické firmy, které provádějí zájemcům genetické testy a na základě výsledků ordinují speciální potravinové doplňky a programy životosprávy šité na míru.
Nedávná kontrola však odhalila, že v nutrigenetice zatím převažuje kšeft a šarlatánství nad solidní vědou a zodpovědným přístupem. Státní kontrolní úřad si objednal u čtyř nutrigenetických firem celkem čtrnáct testů a výsledky kontrolory šokovaly. „Výsledky všech testů mátly zákazníka tím, že z nich byly vyvozovány závěry o zdraví, jež byly nepodložené a tak nejednoznačné, že se z nich zákazník nedozvěděl nic, co by dávalo smysl. Byly to genetické horoskopy,“ řekl šéf kontrolní skupiny Gregory Kutz.
Většina odborníků se přesto shoduje na tom, že bychom neměli nad nutrigenetikou lámat hůl. „Myslím si, že je to správný přístup, ale stávající snahy jsou až příliš uspěchané,“ prohlásil o nutrigenetice John Milner z amerického National Cancer Institute a dodal, že o vztahu výživy a funkce genů toho stále ještě nevíme dost.
Farmakogenetika v léčbě rakoviny
Proč reagují pacienti se stejným onemocněním rozdílně na jeden a tentýž lék? Někomu léčba zabere, jinému nikoli. U dalšího se mohou projevit nežádoucí vedlejší účinky. V pozadí lze tušit vliv různých variant genů, jež si neseme v dědičné informaci.
S přečtením lidského genomu se zdá na dosah ruky uskutečnění vize, v které lékař ordinuje pacientovi „lék na míru“ – preparát, který s ohledem na dědičné založení nemocného skýtá nejvyšší záruky uzdravení a nejmenší rizika komplikací. V současné době se zkouší tento přístup označovaný jako farmakogenetika při léčbě rakoviny.
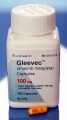
Při některých typech nádorových onemocnění zažívacího traktu se s úspěchem používá lék Gleevec. Ten vyřazuje ze hry bílkovinu KIT, jež nutí nádor k růstu. V první fázi zabírá Gleevec téměř všem pacientům. Po dvou letech však začnou nádorové buňky asi u poloviny pacientů léku vzdorovat. Může za to určitá mutace genu, podle kterého se bílkovina KIT v buňkách vyrábí. Nádory s touto verzí genu KIT jsou však citlivé na lék Sutent. Pokud lékař zná pacientovu variantu genu pro bílkovinu KIT, může se rozhodnout pro lék, u kterého nehrozí selhání.
Epigenetické léky
„Obalení“ DNA určuje aktivitu jednotlivých genů a zprostředkovaně tak diriguje chování buněk ve zdraví i v nemoci. Tyto tzv. epigenetické změny se promítají do vývoje každého jedince a sehrávají významnou roli při stárnutí, nádorových onemocněních, duševních chorobách či neplodnosti.
Velkou pozornost věnují epigenetickým změnám v buňkách onkologové. Ukazuje se totiž, že nevhodné „obalení“ genu může v buňkách napáchat škody zcela srovnatelné s poruchou, při níž dojde ke změně „uvnitř genu“, tedy ke změně v pořadí písmen genetického kódu.
Vznik mnoha typů nádorů umožňuje nečinnost ochranného genu Wnk2. Ten je při vzniku některých nádorů mozku mnohem častěji umlčen epigenetickými změnami než zásadním poškozením.
Epigenetické změny genů předznamenávají i výsledek léčby. Například epigenetické „obalení“ genu pro bílkovinu vázající ženské pohlavní hormony estrogeny určuje, jak zabere léčba nádorů lékem zvaným tamoxifen (T- ??).
Objevují se už i léky, které potlačují nežádoucí epigenetické změny na dědičné informaci nádorových buněk. Americký preparát Vidaza brání vazbě metylových skupin na dvojitou šroubovici DNA. Teoreticky by měl sice působit na všechny buňky těla, ve skutečnosti si ale přednostně vybírá za cíl nádorové buňky a zdravé nechává na pokoji. Vidaza brání obalování genů a ty jsou pak vysoce aktivní. V nádorových buňkách se tak probudí ze spánku i dosud dřímající geny, jež mají na starost ochranu těla před nádorovými buňkami. Výsledkem je potlačení růstu nádoru. Vidaza již byla v USA schválena například pro léčbu „náběhů“ na leukémii, kdy sice tato „rakovina krve“ ještě nestačila propuknout plnou silou, ale začíná se nebezpečně rozjíždět.
Komplikovaná historie genu
1856
Na zahradě brněnského kláštera zahajuje Johan Gregor Mendel pokusy s hrachem. Dochází k závěru, že znaky jsou určeny jakýmisi „jednotkami“, které se přenášejí z rodičů na potomky. Formuluje základní zákonitosti genetiky. Jeho objev však upadne v zapomnění a lidstvo jej docení až v roce 1900.
1909
Dánský botanik Wilhelm Johanssen poprvé používá slovo „gen“ pro jednotku spojenou s určitým dědičným znakem. Podstata genu ale zůstává v té době neznámá.
1910
Americký genetik Thomas Morgan při pokusech na mušce octomilce odhalil, že geny se nacházejí na chromozomech v jádru buňky. Morgan je otcem představy, podle které jsou geny na chromozomu „navlečené“ jeden za druhým podobně jako korálky na šňůrce.
1941
Američtí genetici George Beadle a Edward Tatum představili teorii, podle které je každý gen zodpovědný za produkci jednoho enzymu.
1944
Geny leží na molekule deoxyribonukleové kyseliny (DNA). K tomuto závěru dospělo trio amerických genetiků Oswald Avery, Colin McLeod a Maclyn McCarty.
1953
Britové James Watson a Francis Crick odhalili strukturu dvojité šroubovice DNA. Vzniklo tzv. ústřední dogma molekulární genetiky, podle kterého je základem dědičnosti DNA, jejíž informace se v buňkách přepisuje na molekuly ribonukleové kyseliny (RNA). Podle jednoduché šroubovice RNA se pak syntetizují bílkoviny.
V tomto období se zdálo, že je nám podstata genu nad slunce jasnější. Ale následující roky začaly tento jednoduchý obraz genů a jejich úlohy komplikovat. Ještě v 80. letech stačila profesorům genetiky k vysvětlení toho, co je gen a jak funguje, obvykle jediná universitní přednáška. Dneska jsou stejnou látkou našlapány přednášky v celém semestru.
1977
Genetici Richard Roberts a Phillip Sharp (Velká Británie, USA) odhalili, že geny jsou tvořeny několika segmenty. Také RNA vzniká v odpovídajících segmentech, které se mohou vzájemně různě kombinovat. Tomuto procesu se říká alternativní sestřih RNA. V důsledku alternativního sestřihu může podle instrukcí jediného genu vznikat hned několik různých molekul RNA. Podle nich se v buňce tvoří různé proteiny.
1993
U drobného červíka Caenorhabditis elegans se podařilo odhalit krátké molekuly RNA, tvořené zhruba dvěma desítkami písmen genetického kódu. Tyto molekuly se vymykají z obvyklé role RNA jako prostého „prostředníka“ při vzniku bílkovinné molekuly podle instrukcí uložených v DNA. Tzv. mikroRNA jsou důležité regulační prvky a určují aktivitu genů. Následně byla klíčová role mikroRNA potvrzena i u dalších organismů včetně člověka.
2005
U drobné brukvovité rostliny huseníčku Thalova byla objevena RNA, která zpětně ovlivňuje pořadí písmen v molekule DNA a je schopna „přepsat“ pořadí písmen genetického kódu v DNA. Huseníček tak může opravovat nově vzniklé chyby ve svých genech.
2006
U myší byl objeven gen, jehož varianta vyrábí anomální RNA. To má kromě jiného za následek bílé zbarvení tlapek a špičky ocásku. Tato RNA se dědí a je s to donutit k tvorbě anomální RNA i dědičnou informaci, která už variantu genu pro její tvorbu nenese. Gen pro anomální RNA z dědičné informaci mizí, ale RNA se tvoří dál a přenáší se v pohlavních buňkách z generace na generaci. Znamená to, že se rodí myšky s bílými ocásky a tlapkami, které už pro tento znak nemají instrukci v DNA. V roli „nositele dědičnosti“ nevystupuje DNA ale RNA. Jde o dědičnost bez genů. Odborně se tomuto jevu říká paramutace.
2006
Asi 5 % všech proteinů vzniká podle informace několika různých genů. RNA pro tvorbu těchto proteinů se začne tvořit celkem spořádaně podle jednoho genu, ale pak si to uprostřed práce rozmyslí a přeskočí na jiný gen vzdálený často mnoho tisíc písmen genetického kódu. Tam pak RNA pokračuje v syntéze podle instrukcí jiného genu. Vzniká tak „hybridní“ RNA a následně i „hybridní“ protein, který v sobě nese části dvou zcela různých proteinů.