Endogenní retroviry, které před miliony let napadly naše předky a staly se součástí lidské DNA, již zásluhou evoluce nevyvolávají v našich organismech infekci, ale některé jejich geny nám naopak prospívají.
Stávají se totiž předlohou syntézy několika bílkovin obohacujících buňky o nové nepostradatelné funkce. Na „nepravých místech“ však může tato jinde vítaná životodárná schopnost působit kontraproduktivně a naše zdraví ohrožovat.
Tým virologů vedený Dr. Jiřím Hejnarem z Ústavu molekulární genetiky AV ČR nyní popsal mechanismy, které tyto procesy v našem těle regulují.
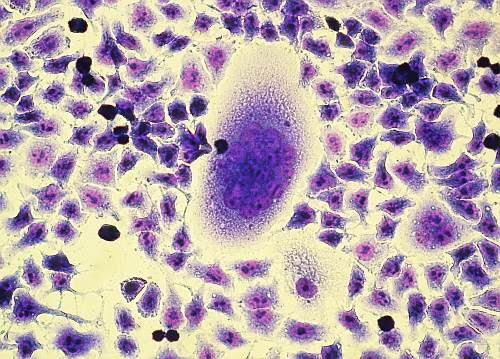
Mezi zmíněné bílkoviny patří i syncytin-1 a -2, původně retrovirové obalové glykoproteiny, které měly za úkol splynutí virové částice s hostitelskou buňkou. Oba syncytiny se nacházejí na povrchu specializovaných buněk placenty a svojí aktivitou nutí tyto buňky k fúzi.
V oblasti kontaktu s děložní sliznicí tak vzniká vrstva splynutých buněk, která je zcela nezbytná pro správnou výměnu živin a plynů mezi krevními oběhy matky a plodu. Snížené množství syncytinu-1 v buňkách placenty pozorujeme u těžkých komplikací těhotenství (tzv.
preeklampsie) způsobených špatným zásobováním plodu kyslíkem a živinami. Zatímco v placentě je přítomnost syncytinů nezbytná, v ostatních tkáních nejsou tyto proteiny žádoucí a splývání buněk mimo placentu by mohlo vést k poruchám.
Přítomnost syncytinu-1 byla např. prokázána v mozku pacientů s roztroušenou sklerózou. Je zřejmé, že organismus musí tvorbu syncytinů velmi striktně usměrňovat.
Jak však taková regulace probíhá? Informace z genové deoxyribonukleové kyseliny (DNA) je v procesu zvaném transkripce přepsána do ribonukleové kyseliny (RNA), která je následně upravena (sestřižena) a poté použita jako předloha pro produkci příslušné bílkoviny, v našem případě syncytinu.
Vědecký tým Dr. Hejnara ukázal, že regulace genů pro syncytiny spočívá v chemických úpravách (methylace DNA, methylace histonů) řídících částí genů. Tyto úpravy brání přepisu genů do RNA, a tudíž i následné syntéze syncytinu.
Druhou úrovní regulace je sestřih, který správně funguje jen v placentě. Nesestřižené molekuly RNA, pokud by i přes první bariéru vznikly v buňkách mimo placentu, nemohou být použity pro tvorbu syncytinů.
V této souvislosti hraje významnou roli i zjištění, že syncytinová RNA je úspěšně přepisována i sestřihována v nádorech zárodečné linie (seminom, choriokarcinom, smíšený germinální karcinom). Deregulace syncytinu-1 zde tedy může umocňovat zhoubný potenciál nádorů.
„Popsané výsledky významně přispívají k lepšímu porozumění tkáňově-specifické regulace syncytinů. Nové poznatky o regulaci těchto proteinů by mohly být využity k upřesnění klasifikace nádorů stejně jako v diagnostice, prevenci či léčbě poruch placenty, které zůstávají závažnou komplikací těhotenství i ve vyspělých zemích.
V teoretické rovině se jedná o názornou ukázku procesu, jímž jsou původně virové geny přizpůsobovány novým buněčným funkcím. Podobný proces proběhl v historii savců nezávisle ve všech vývojových liniích s dokonalým typem placenty, jako jsou primáti, hlodavci a šelmy.
Evoluce nás neustále udivuje tím, jak dokáže pracovat i s genetickým odpadem pocházejícím z nebezpečných parazitů,“ vysvětluje Dr. Jiří Hejnar.
obrázek: Buňky v kultuře, které (uprostřed zorného pole) splývají v mnohojaderné syncytium pod vlivem syncytinu-1
– TZ AV ČR –









