Viry a bakterie mezi sebou bojují o přežití už miliardy let. Až nyní se ale o tento souboj začínáme zajímat i my, protože by nám mohl přinést nové strategie pro boj s infekcemi, se kterými si antibiotika nedokáží poradit. Pomohou nám viry?.
Vzhledem k tomu, že se bakterie neustále vyvíjí a jejich hlavním cílem je přežití, budují si stále větší odolnost vůči lékům, jejich prostřednictvím se je lidstvo snaží zastavit, tedy antibiotikům. Tato krize, během které je stále obtížnější vyléčit dříve snadno léčitelné infekce, je známá jako antimikrobiální rezistence (AMR).
Ta je již dnes odpovědná za více než milion úmrtí ročně po celém světě, toto číslo navíc rychle roste. Světová zdravotnická organizace (WHO) proto označila AMR za jednu z deseti největších globálních hrozeb pro veřejné zdraví.
Viry představují pro bakterie další hrozbu. Na pomyslném vrcholu mezi nimi stojí tak zvané fágy, což jsou viry uzpůsobené k tomu, aby našly, infikovaly a zabily bakterie. Dělají to tak ostatně už miliardy let.
Nyní se tato dlouhověká bitva mezi bakteriemi a fágy začíná těšit pozornosti odborníků, neboť by mohla nabídnout lidstvu vodítka, jak bojovat proti infekcím rezistentním vůči antibiotikům. Fágové terapie, tedy využití fágů k léčbě bakteriálních infekcí, si začínají získávat pozornost jakožto potenciální řešení AMR.
Fágy jsou schopné potlačit bakteriální infekci
Fágy jsou vysoce specifické a schopné zacílit i na kmeny rezistentní vůči lékům. U některých pacientů, kterým byla fágová terapie nabídnuta ze soucitu, jakožto poslední možnost, se jejím prostřednictvím podařilo vyléčit infekce tam, kde selhala všechna antibiotika.
Fágy ovšem také neustále čelí výzvě, a tou jsou samotné bakterie. Ty si totiž vyvinuly sofistikované systémy pro detekci a ničení fágů. Tyto obranné mechanismy mají různou podobu – některé bakterie rozřezávají virovou DNA, jiné jim blokují vstup, další spouští jakýsi intracelulární blok, aby zabránily virům převzít nad nimi kontrolu.
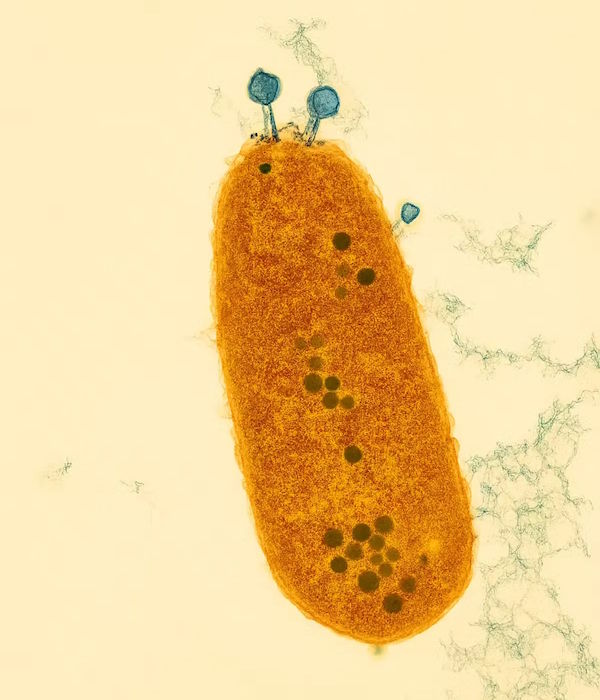
Franklin Nobrega, docent mikrobiologie z University of Southampton, nyní v časopise Cell popsal další bakteriální obranný mechanismus, který spolu s kolegy pojmenoval Kiwa. Ten funguje jako jakýsi senzor, zabudovaný do bakteriální membrány, který časně detekuje známky útoku.
Podle Nobregy reaguje na mechanický stres, ke kterému dochází, když se fág přichytí k bakterii a vstříkne do ní svoji DNA. Jakmile je Kiwa spuštěna, působí rychle. Zastaví schopnost fága tvořit další fágy, čímž předejde rozvoji infekce předtím, než ji zcela ovládne.
Kdo s koho: bakterie versus fágy
Ovšem, stejně jako si bakterie vytvářejí mechanismy, jak se bránit útoku fágů, ty si vyvíjejí strategie, jak je obejít. Některé fágy si proto vytvořily malé mutace v proteinech, které používají k připojení se k bakteriálnímu povrchu tak, aby nedošlo ke spuštění Kiwa.
Jiné volí odlišný způsob, nechají se systémem odhalit, ale jsou schopny uniknout následkům. Vědci si zatím nejsou jisti, jak přesně to dělají, ale mohou se replikovat uvnitř bakterie i poté, co dojde k aktivaci Kiwy.
Dokáží to ovšem jen některé druhy fágů s vhodnými mutacemi. Odborníci se nyní zabývají studiem různých druhů fágů a věří, že do budoucna budou schopni předpovědět, jaké obranné mechanismy využívá ten který bakteriální kmen, a vybrat fágy, které jsou přirozeně vybaveny či budou uměle vyladěny k jejich překonání.
Kiwa je jen jedním z mnoha obranných mechanismů, které bakterie využívají. Některé detekují virovou DNA přímo, jiné vnímají poškození nebo stres a další dokonce koordinují reakce se svými sousedy. Čím více o souboji virů a bakterií odborníci vědí, tím lépe budou moci v budoucnu zvolit vhodnou fágovou terapii k léčbě bakteriálních infekcí rezistentních vůči antibiotikům.
Zdroj: Livescience