Když se vědci naučili číst genetický kód, pomalu se učí rozumět jednotlivým genům a měnit je. Tak se rozvíjí genové inženýrství. Na počátku mělo mnoho odpůrců a vyvolalo množství diskusí. Velmi specifickým směrem se vydala genová terapie – léčebný postup založený na zásazích do lidského genomu. Co všechno je možné v manipulacích s geny?
Genové inženýrství dokáže stvořit organismus s takovou kombinací genů, která v přírodě do té doby neexistovala. Zabývá se nejčastěji kvasinkami a bakteriemi. Ne proto, že by si na něco většího netrouflo, zahrává si klidně i se savci, ale z praktického hlediska.
Bakterie a kvasinky jsou jednoduché organismy s krátkou reprodukční dobou a jednoduchou kultivací. Speciální odnož genového inženýrství, genová terapie, naopak zamířila k tomu nejsložitějšímu – k terapeutickým manipulacím s lidským genomem.
Bájná chiméra a lidské hormony
Genoví inženýři dokážou najít gen kódující určitou molekulu v jednom organismu a přenést ji do organismu jiného. Dokážou zkonstruovat in vitro (ve zkumavce) zcela nové i tzv. chimerické molekuly DNA (deoxyribonukleové kyseliny).
To znamená molekuly poskládané z částí genomů izolovaných z buněk organismů odlišných druhů, rodů i říší.
Stejně tak byla poskládaná bájná chiméra (viz rámeček). Vědci umějí geny zkombinovat tak, že jsou ve velmi složitém buněčném systému správně přečteny a překládány do proteinů. To všechno se odehrává převážně v mikrozkumavkách a v kultivačních médiích.
Nová generace vakcín
Manipulace s geny umožnily výrobu nové generace vakcín (např. proti virům způsobujícím hepatitidu A a B nebo chřipkovému viru). Kvasinky nebo bakterie nesou geny, díky nimž produkují ve velkém množství lidské hormony, např. inzulin (hormon regulující energetický metabolismus), somatostatin (souvisí např. s regulací růstového hormonu, hormonů slinivky břišní i štítné žlázy) nebo řadu hormonů působících v mozku (např. endorfin).
Bakterie s tzv. rekombinovanou DNA, tedy s DNA, ve které je vložený nový gen, »umí« také ve velkém produkovat mimořádně čisté aminokyseliny, alkaloidy či rostlinné růstové hormony (gibereliny).
Klonované mléko pro kojence?
Cizorodé geny je možné vnášet i do buněk vyšších organismů s cílem změnit některou z jeho vlastností. V letošním roce byl například publikován výsledek projektu čínských vědců, který umožnil použít kravské mléko pro výživu kojenců.
Vědci naklonovali do buněk skotu geny pro lidský enzym (lysozym). Podle prvních výsledků se na dalších vlastnostech pokusných krav vnesený gen nijak neprojevil a nadojené mléko skutečně potřebný enzym obsahuje.
K čemu je potřebný? Kravské mléko po této úpravě může být lépe přijatelné pro kojence jako náhražka chybějícího mateřského mléka. Lysozym navíc dokáže narušovat buněčné stěny bakterií, takže výrazně stimuluje funkce imunitního systému, usnadňuje tvorbu protilátek.
Jiné manipulace tohoto druhu vedou třeba u skotu ke zvýšené tvorbě svaloviny, laicky řečeno je pak z jedné krávy víc steaků. Protože je to na rozdíl od změny složení mléka změna viditelná, budí trochu rozpaky.
Manipulace s geny živých buněk?
Pojďme se podívat, co už dokáže nejnáročnější a nejzodpovědnější odnož genového inženýrství, genová terapie. Je cílená na lidské pacienty a vyžaduje obrovské množství přípravných pokusů a testů, protože zasahuje do živého organismu.
Potřebuje najít porouchaný gen, potřebuje hledat způsob, jak opravenou část DNA vpravit bezpečně do živé buňky v živém těle. Cílem genové terapie je vložit do genomu pacienta takovou část, neboli sekvenci DNA, která nahradí poškozený či chybějící úsek.
Vir jako hodný sluha
Mohla by být používána pro léčbu dědičných onemocnění i nově vzniklých genetických poruch. Jedním z těch těžších kroků, které musí genová terapie řešit, je právě bezpečné a cílené vložení »náhradní« DNA do genomu pacienta.
Pro tento účel často používá upravené viry (viz rámeček), které znají přirozený způsob, jak lehce do buněk pronikat.
Upraveny musejí být proto, aby ztratily svou původní patogenitu, schopnost se množit nebo nevyvolávaly nežádoucí reakce hostitelského organismu. Pro takto upravené viry se používá název virové vektory.
Genová terapie má za sebou své úspěchy i neúspěchy, učí se a zdokonaluje a některé výsledky, kterých dosahuje, jsou pro budoucnost velmi slibné.
Vektory závislé na kofeinu
V metodách přípravy a produkce virových vektorů (viz rámeček) někdy výsledek překvapí. Jednoduchou a levnou strategii pro zvýšení produkce lentivirů objevil se svými kolegy Brian Ellis z medicínského výzkumného centra univerzity v Dallasu v USA. Jejich vektory mají hned několik výhod.
Nejsou tak riskantní z hlediska možných nežádoucích imunitních reakcí jako dříve používané adenoviry a na rozdíl od určitého typu retrovirů vnášejí dědičnou informaci i do buněk, které se nemnoží.
Lentivirové vektory jsou stále více využívány v laboratořích i při klinických testech a tím, co zvyšuje jejich titr (množství virových částic), je kofein. Koncentrace kofeinu je samozřejmě důležitá, protože příliš vysoká by byla toxická pro buňky a virová produkce by se nezvýšila.
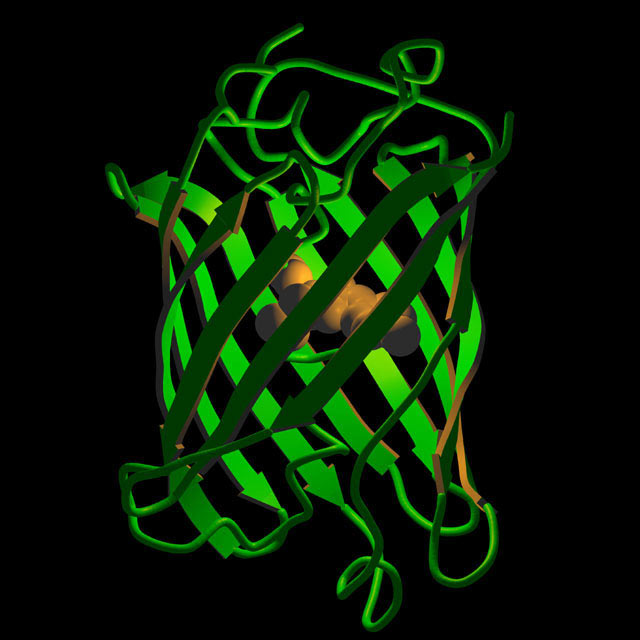
Detekce medúzou
Na jiném místě tohoto čísla je řeč o medúzách. Genetici ve spolupráci s onkology a laboratoří pro výzkum rakoviny v britském Yorkshire vyvinuli metodu, která využívá právě protein z buněk medúzy k diagnostice nádorů ukrytých uvnitř lidského těla.
„Zhoubný nádor v počátečním stadiu hluboko uvnitř těla je obtížné diagnostikovat. Přitom právě včasná diagnóza je zásadní pro úspěšnou léčbu všech forem rakoviny,“ říká vedoucí týmu profesor Norman Maitland.
„Podařilo se nám vyvinout proces, který umožňuje vnesení bílkovin získaných z buněk medúzy do lidských nádorových buněk. Speciální kamera pak detekuje tyto bílkoviny, protože se rozsvítí a označí, kde jsou nádory lokalizovány.“.
Gen pro syntézu zeleně fluoreskující(ho?) proteinu (green fluorescent protein, GFP) mají vědci na hraní už dlouho, ale toto je jedna z velmi podstatných aplikací. Gen vnáší cíleně, selektivně, do nádorových buněk primárního nádoru i metastáz (vzdálených ložisek, vzniklých z uvolněných buněk prvotního nádoru) virus.
V nádorových buňkách se gen začne intenzivně přepisovat a překládat a tím se množí hotové molekuly svítícího proteinu.
Vědci ještě trochu pozměnili barvu, ve které se protein zobrazuje, aby vyhovovala detekčním podmínkám. Tato slibná metoda by měla být připravena v blízké budoucnosti pro klinické zkoušky. Limitující je v tomto případě i optický detekční systém, který musí být schopný detekovat záření ve všech vrstvách těla.
Stručně o zázraku
Tým výzkumníků z Japonska, Jižní Koreje a USA vyvinul novou metodu genové terapie, zaměřené na léčbu infekce HIV (Human Immunodeficiency Virus – virus lidské imunitní nedostatečnosti).
Do tzv. CD4 T-buněk (speciální typ bílých krvinek, buněk imunitního systému, který virus HIV napadá) se vnese bakteriální gen z bakterie Escherichia coli, jenž »zakáže« buňce provádět procesy vedoucí k syntéze proteinů. Vědci ho upravili tak, aby jeho fungování zapínala právě infekce HIV.
Zdravá buňka tedy funguje normálně, pouze v případě infekce HIV je zablokováno množení viru a T- buňky jsou vůči němu rezistentní. Stručně tak bylo publikováno něco, co velmi důmyslným způsobem programuje buňky a může zachránit mnoho lidských životů.
Genová terapie pro srdce
Genová terapie se ukázala jako možný prostředek i při léčbě pacientů s ischemickou chorobou srdeční, trpící nedostatečným prokrvením srdečního svalu, které může způsobit selhání. Pozornost se obrátila i ke genové terapii.
Ovšem ta sama o sobě neměla výrazné výsledky. Nadějné se ukazuje až její využití v kombinaci s kmenovými buňkami (to jsou »univerzální buňky«, z nichž pak vyzrávají buňky specializované). Do transplantovaných kmenových buněk, ze kterých se mohou vytvářet nové buňky srdečného svalu, může být vnesen gen pro faktor VEGF (podporuje novotvorbu cév).
Geny vhodné pro léčbu depresí?
Genovou terapií by odborníci rádi léčili i duševní onemocnění. Na myším modelu zkoušeli vědci z newyorské Rockefellerovy univerzity touto metodou léčit depresi. Našli gen nazvaný p11, který prokázali jako související s rozvojem depresivního onemocnění u lidí a jehož produkt (protein, který se podle něho kóduje) detekovali jako nedostatečný v jednom z mozkových jader koncového mozku.
Použili proto hlodavce, kteří měli tento gen narušený ve všech buňkách těla. Těmto myším pak vstříkli přímo do sledované oblasti mozku virový vektor s nenarušeným genem p11. Výsledek byl velmi slibný, projevy deprese u myší ustoupily.
Genová terapie by mohla pomoci i při léčení nejčastějšího a často smrtelného mozkového nádoru – glioblastomu.
„Je zřejmé, že všechny glioblastomy nejsou stejné. Představují tak trochu sbírku různých molekulárních a genetických subjektů, které se chovají jedinečně a vyžadují individuální přístup,“ říká profesor radiační onkologie Arnab Chakravarti z univerzity v americkém Ohiu.
Vědci dosáhli toho, že po změně metylace (úprava DNA navázáním metylových skupin na určitá místa) reagovali pacienti na léčbu lépe.
Gen, který mírní senilní demenci
Genové inženýrství našlo své místo i v terapii stále rozšířenější nemoci, Alzheimerovy choroby (způsobuje odumírání mozkových buněk). Mark H. Tuszynski, neurolog z Kalifornské univerzity v San Diegu, a neurochirurg Hoi Song U uskutečnili experiment na hranici představivosti.
Pomocí speciálních operačních technik vnesli osmi dobrovolníkům do mozku jejich vlastní epidermální buňky (buňky pokožky). Tyto buňky byly geneticky upraveny tak, aby produkovaly ve zvýšené míře nervový růstový faktor (NGF), podporující růst nervových buněk.
Pacienty sledovali po dobu jednoho roku a zjistili, že se výrazně snížilo množství odumřelých nervových buněk, až o 50 %. Velkou naději také znamená to, že vlastní kožní buňky nevyvolávají negativní reakci imunitního systému a při dalším růstu a množení nedošlo k jejich nádorovému zvratu.
Dvě špičkové technologie
Genová terapie může najít podporu i v dalším novém vědním oboru – nanotechnologiích. Vědci z univerzity v irském Belfastu dokázali do buněk karcinomu prsu dostat gen, který způsobí jejich destrukci.
Potřebný gen zabalili do nanočástic 400x menších než šířka lidského vlasu, díky čemuž ho bylo možno nasměrovat přímo do nádorových buněk ve tkáňové kultuře. Systém se nazývá Designer Biomimetic Vector a do buněk nádoru prsu zanesl gen zvaný iNOS, který nutí buňky k produkci oxidu dusnatého a v určitém množství je pro buňku jedovatý.
Velmi zajímavá perspektiva je to, že současně zůstávají naprosto nedotčené zdravé buňky, čímž by tato metoda překonala mnoho současných metod s velmi zatěžujícími nežádoucími účinky.
Děsivé všezvíře
*Chiméra, řecky Chimaira, je dcerou mýtického, stohlavého obra Týfóna a Echidny – půl ženy, půl hada.
*Z takového genetického šílenství vznikla fantastická nestvůra – zpředu měla podobu lva, uprostřed vypadala jako divoká koza a zezadu jako drak.
*Z každého zvířete narostla i hlava a všechny tři dštily oheň, což obzvláště u té kozí muselo být působivé.
*Podle řeckých bájí žila v Lykii, kde v sopečné puklině střežila vchod do podsvětí.
*Její sourozenci byli podobně zajímaví – dvouhlavý pes Orthos a tříhlavý podsvětní pes Kerberos. Také Sfinx, Sfinga, obluda se ženskou hlavou, lvím tělem a orlími křídly, kterou zabil až Oidipus v Thébách.
*Právoplatným členem této strašlivé rodiny byla i Hydra, obluda s hadím tělem a deseti až třinácti hlavami, kterou s mírnou dopomocí porazil až Héraklés.
*Dnes se slovo chiméra obecně používá jako synonymum něčeho nereálného, neuskutečnitelného, přeludného.
*V genetice je blíž svému původnímu významu. Představuje uměle sestavený úsek DNA.
Upravené viry léčí
*Viry mají schopnost zabudovat svou genetickou výbavu do genomu buňky, kterou napadnou a použijí její nástroje k množení sebe sama.
*Vědci zjednodušeně řečeno přišli na to, že ponechají-li viru geny potřebné pro jeho zabudování do buňky a vystřihnou ty, které způsobují onemocnění, mohou virus použít pro léčebné účely jako tzv. virový vektor.
*Namísto vystřihnutých genů vědci do virů vkládají geny, které pacient potřebuje.
*Zjednodušeně to sice vypadá jednoduché, ale existuje mnoho potíží, které používání virových vektorů komplikují.
*Je třeba například zajistit, aby virus infikoval pouze ty správné buňky, třeba buňky určitého typu nádoru. Aby se gen dopravený virem, který se zapojí do lidského genomu, zapojil ve vhodném místě, tj.
aby neporušil zdravé funkční geny. V opačném případě může totiž naopak infekce virem způsobit odmítavé reakce organismu nebo nekontrolované dělení buňky, vedoucí ke vzniku nádoru.
*Vědci proto zkoušejí různé typy virů, například retroviry, adenoviry, tzv. adenoasociované viry nebo lentiviry.
Metody, které se obejdou bez virů
*Nevirové metody vnášení potřebných genů do nemocné buňky měly v minulosti svá omezení, například v tom, že byly málo účinné. Opravné geny se ve srovnání s viry dostaly jen do malého počtu buněk.
*Dnes se vědcům daří takové potíže řešit, a tak je tyto techniky také třeba brát vážně. *Nejjednodušší metoda je přímé vnášení »holé« DNA do buněk například nastřelováním velmi malých částeček zlata s navázanou DNA, nebo elektroporace (působení elektrických impulzů, které mění prostupnost buněčné membrány).
*Další metody vycházejí z principu molekulární genetiky – krátké fragmenty DNA mohou »zalepit« nemocný úsek tak, že se nepřekládá do proteinu (bílkoviny).
*Jinou z mnoha testovaných možností jsou třeba tzv. lipoplexy, DNA zvláštním způsobem chráněná vazbou na molekuly lipidů (tuků). S dalšími možnostmi přichází využití nanotechnologií.









