Veškerý svět kolem nás se skládá z atomů. Ty ovšem nejsou vždy stejné, v mnohém se od sebe odlišují. Každý má sice obal a jádro, ale v něm jsou další částice, protony. A právě jejich počtem se různé chemické prvky liší. Kde se však vzaly? Jaké mají vlastnosti a proč?
Chemické prvky slouží i ve válkách!
Pestrost přírody okolo nás má na svědomí 92 chemických prvků. Několik dalších jich pak bylo vyrobeno uměle v laboratořích. Stačí totiž jen malý rozdíl v počtu protonů v jádru a chování prvku je úplně jiné.
Který prvek existoval jako první? Snadná odpověď, musel to být ten, který měl a má jeden jediný proton v jádru atomu, tedy vodík. Vědci jsou přesvědčeni, že po „velkém třesku“, tedy okamžiku, kdy vznikl vesmír, se objevily první atomy vodíku a posléze i helia. To už ovšem má ve svém jádru dva protony. První generace hvězd pak měly být čistě vodíkové.
Až když tyto hvězdy dospěly ke svému zániku, začaly se v jejich jádrech odehrávat zajímavé reakce. Docházelo ke spalování lehkých prvků a vznikaly těžší atomy. Nejvyšší atomové číslo těchto prvků bylo 26, vzniklo tedy například železo, kyslík, dusík nebo uhlík.
Když se pak hvězdy zhroutily samy do sebe a došlo k jejich explozi (supernova), těžší prvky z jejich jader byly vystřeleny do okolního vesmíru. Přitom zároveň docházelo k neskutečnému množství dalších reakcí, které daly vzniknout dalším a dalším prvkům, tedy těm, které jsou těžší než železo.
Podívejme se nyní blíže na některé prvky chemické soustavy. Jak vznikly a k čemu jsou dobré?
Přátelský vodík
Začneme nejstarším mezi chemickými prvky, vodíkem.
Za běžných okolností je vodík plyn, ze kterého je utvořena drtivá část veškeré hmoty ve vesmíru. Z toho vyplývá i jeho nesmírně široké praktické využití. Lze jej například použít jako nevyčerpatelný zdroj energie. V okolním kosmu je ho vždy dostatek a až lidstvu dojdou tradiční fosilní paliva, může je nahradit právě vodík. V každodenní praxi se pak nejlehčí prvek používá nejen jako redukční činidlo v chemické syntéze, ale třeba i jako náplň balonů a vzducholodí, byť poněkud třaskavá.
Na zemi se atomární vodík téměř nevyskytuje, zato plynný vodík se v našem prostředí objevuje ve formě dvouatomových molekul H2. S výjimkou vzácných plynů se vodík kamarádí se všemi prvky. Dokáže s nimi tvořit nejrůznější sloučeniny, které jsou nutné i ke vzniku života. Koneckonců, vždyť i molekula obyčejné vody obsahuje dva atomy vodíku.
Perspektivně jsou izotopy (atomy stejného prvku, které se liší počtem neutronů) vodíku pokládány za hlavní energetický zdroj při využití řízené jaderné fúze, kdy lze slučováním lehkých atomových jader získat velmi významný energetický efekt. V současné době je však tento energetický zdroj pouze ve stádiu experimentálních prototypů a jejich zavedení do reálné praxe lze očekávat až v průběhu několika dalších desítek let. K praktickému využití jaderné fúze došlo zatím pouze při výrobě termonukleární bomby a lze jen doufat, že experimenty vedené tímto směrem nebudou dále pokračovat.
Víte, že…
… vodík objevil v roce 1766 anglický chemik a fyzik Henry Cavendish?
… z každých 100 atomů zemské kůry 17 patří vodíku?
… 76 % kosmické hmoty připadá na vodík?
… každou sekundu se na Slunci změní na energii kolem 4 milionů tun vodíku?
… při „spalování“ 1 g jader vodíku se uvolní energie 20 milionkrát vetší, než při spalování stejného množství uhlí?
… zásoby vodíku na Slunci vystačí na 30 miliard let?
… helium na Slunci bylo objeveno o 13 let dříve než na Zemi?
… helium na Slunci objevil 19 srpna 1868 francouzský vědec Pierre Janssen a 20. října téhož roku i anglický vědec D. N. Lockyer?
… na 1 kg pozemského materiálu připadá jen 0,003 mg helia?
… obsah helia ve vzduchu je 0,00052 %?
… 23 % kosmické hmoty připadá na helium?
… podle různých údajů atmosféra Jupitera obsahuje 17 – 33 % helia?
Helium je vzácný samotář
Přibude-li do atomového jádra jeden proton, máme z vodíku helium. Zatímco se vodík v chemických reakcích přátelí s kdekým, helium je samotář. Není totiž známá jediná sloučenina, ve které by helium bylo zastoupeno.
Helium je bezbarvý plyn bez chuti a zápachu a je na Zemi přítomno jen velmi vzácně. V zemské atmosféře se vyskytuje jen ve vyšších vrstvách a díky své mimořádně nízké hmotnosti postupně z atmosféry vyprchává do meziplanetárního prostoru.
V menším množství ho najdeme v zemním plynu, z něhož se také získává vymrazováním. Vzácně vyvěrá helium i z trhlin v zemi – nejznámější takovou oblasti jsou Skalisté hory v USA. Předpokládá se, že veškeré toto helium je produktem jaderného rozpadu prvků v zemské kůře.
Podivná tekutina
S heliem je spojen zajímavý fyzikální úkaz, zvaný supratekutost. Kapalné helium se totiž vyskytuje ve dvou formách – helium I a helium II (při teplotách nižších než –271oC).
Zatímco helium I se chová jako běžné tekutiny, helium II si počíná velmi neobvykle. Především tato kapalina nemá prakticky žádné vnitřní tření, a proto teče nesmírně rychle. Dokonce díky kapilárnímu jevu přetéká stěny nádob, ve kterých je uchováno a vytéká horním koncem do něj ponořené kapiláry (jev zvaný fontánový efekt), což budí zdání, jako by helium II nebylo vůbec ovlivněno gravitací.
Bez uhlíku by neexistoval život
Obraťme však nyní naši pozornost k prvku s atomovým číslem šest. Život, který známe, je totiž založen na bázi uhlíku. Uhlík je velmi šikovný prvek, který dokáže vytvořit až čtyři vazby (podobné vlastnosti má třeba i křemík, jenže jeho vazby nebývají tak pevné). Uhlík je tak základním stavebním kamenem všech organismů na naší planetě, v současnosti je známo na 10 milionů jeho organických sloučenin Z těch anorganických je nejznámější oxid uhličitý CO2 nebo dvě vysoce toxické látky, oxid uhelnatý CO či kyanovodík HCN.
Uhlík využíváme na každém kroku. Jeho sloučeniny například tvoří základ světové energetiky v podobě fosilních paliv. Ale zdaleka nejen to. Veškeré plasty, nátěrové hmoty, ale i farmaceutické výrobky jsou vyrobeny na bázi uhlíku.
Čistý elementární uhlík se v přírodě vyskytuje ve dvou variantách. První je grafit neboli tuha, která je tvořena uhlíkem krystalizujícím v šesterečné soustavě a patří mezi nejměkčí známé nerosty.
Pokud se uhlík srovná do soustavy krychlové, vznikne diamant. Není asi nutné zdůrazňovat, že tento nerost je velmi vzácný a proto velice ceněný. Největším doposud nalezeným diamantem byl Cullinan, nalezený v Jihoafrické republice, který v surovém stavu při vážil 621 gramů (3 106 karátů).
Se spermiemi si rozumí
Hned po uhlíku následuje v periodické tabulce další důvěrně známý prvek, dusík, který má ve svém jádru sedm protonů. Tvoří největší část zemské atmosféry (78 procent).
Za běžných podmínek si dusík rozumí jen s lithiem a plutoniem. Když se ale okolo dusíku zvedne teplota a on se dostane do nálady, dokáže vytvořit třeba nějaký ten oxid dusíku nebo čpavek.
Průmyslově se dusík vyrábí destilací zkapalněného vzduchu. V kapalném skupenství je pak používán k uchovávání tkání, spermií či vajíček. Kapalným dusíkem jsou rovněž chlazeny polovodičové detektory rentgenového záření ve spektrometrech. Dusíkaté sloučeniny se využívají i jako účinná zemědělská hnojiva.
Může dojít i k výbuchu?
Dalším životně důležitým prvkem je kyslík. Ten tvoří 21 procent zemské atmosféry. Jestliže jsme zmínili, že vodík se rád přátelí s kdekým, tak kyslík se do vztahů vrhá přímo po hlavě. A to tak, že výsledkem může být i výbuch. To tehdy, když slučování kyslíku s některými prvky probíhá v prudké reakci (hoření), což vede k uvolnění značného množství tepelné a světelné energie.
V přírodě se čistý kyslík obvykle vyskytuje jako dvouatomová molekula. Pokud jsou v molekule atomy tři, jedná se o ozón, což je vysoce reaktivní plyn modré barvy s mimořádně silnými oxidačními účinky. Ozónová vrstva v horních patrech atmosféry chrání pozemský život před smrtonosným ultrafialovým zářením. Naopak přízemní ozón, vznikající v horkých dnech za podpory výfukových plynů, je zdraví škodlivý.
Podobně jako dusík, i kyslík se vyrábí destilací vzduchu a uchovává se buď ve zkapalněném stavu ve speciálních nádobách nebo plynný v ocelových tlakových lahvích. Vzhledem k vysoké reaktivitě čistého kyslíku je nezbytné, aby se nedostal do přímého kontaktu s organickými látkami. Proto se všechny součásti aparatury pro uchovávání a manipulaci s kapalným nebo stlačeným kyslíkem nesmí mazat žádnými organickými tuky nebo oleji.
Kyslík se používá například v lékařství, především k podpoře dýchání pacientů. Při hoření směsi kyslíku s vodíkem lze dosáhnout teploty přes 3 000 °C. Proto se kyslíko-vodíkový plamen využívá k řezání oceli a tavení kovů s vysokým bodem tání, například platinových kovů.
Kyslíkové tragedie
Když vznikal americký program Apollo, který měl vynést člověka na Měsíc, bylo schváleno, že atmosféru kabiny bude tvořit čistý kyslík. Důvod? Snížení tlaku v kabině na třetinu běžné hodnoty a tím odlehčení její hermetické konstrukce. Jenže 27. ledna 1967 došlo při pozemních testech k tragédii, kterou nikdo nečekal. Hlavní roli v ní sehrál právě kyslík za přispění elektrické jiskry. Ta přeskočila z elektrických rozvodů a během okamžiku byla celá kabina, ve které se v tu chvíli nacházeli tři astronauti, v plamenech. Než se technikům podařilo hermeticky uzavřenou kabinu otevřít, všichni tři uhořeli. Virgil I. Grissom, Edward H. White a Roger B. Chaffee se tak stali prvními astronauty v NASA, kteří položili život při dobývání vesmíru. Pro příští lety byl proto objem kyslíku v kabině snížen na 60 procent, zbytek tvoří dusík.
Na následky požáru v atmosféře naplněné kyslíkem zemřel roku 1961 také sovětský kosmonaut Valentin Bondarenko, když po ukončení lékařských testů jím odhozený kousek vaty namočený v ethanolu dopadl na žhavou elektrickou desku.
Nejužitečnějšími prvky jsou kovy
Mezi nejvyužívanější a nejužitečnější prvky patří kovy. Asi největší „legrace“ je se sodíkem. Když se totiž dostane do kontaktu s vodou, jeho reakce je velmi výbušná. Nechávat čistý sodík jen tak na vzduchu se také nevyplácí, protože reakce je podobná. Roztavený kovový sodík se často uplatňuje v jaderné energetice jako látka odvádějící teplo, vznikající jaderným rozpadem uranu v primárním okruhu jaderného reaktoru.
Podstatně mírumilovnějším kovem je velmi lehký bělavě šedý hliník, který velmi dobře vodí elektrický proud. Proto je široce používaný v elektrotechnice. Ve formě slitin se sním pak setkáváme v leteckém průmyslu a mnoha dalších aplikacích, například i v mincích. I alobalová folie je z tohoto kovu.
Éru počítačů si zas nelze představit bez křemíku. Je to vlastně polokov (přechod mezi kovy a nekovy), podobně jako třeba arsen či germanium, ale velice důležitý. Křemík se rád kamarádí s kyslíkem a právě po něm je druhým nejhojnějším prvkem v zemské kůře.
V praxi se používá při výrobě čipů, ale nalezneme ho i ve skle, v silikonech nebo v keramice.
Proč jsou kovy drahé?
Jakmile se člověk naučil zpracovávat železo (3. tisíciletí př. n. l.), učinil tím zásadní krok k vyspělé civilizaci. Ze železa se vyrábí litina nebo ocel a s těmi se pak v běžném životě setkáváme na každém kroku.
Zajímavé jsou i drahé kovy, mezi něž patří především stříbro, zlato a platina. Přívlastek „drahé“ však nemá s chemií nic společného, je spíše dán jejich vzácností v přírodě a z toho vyplývající hodnoty. Stříbro se může pyšnit nejlepší elektrickou a tepelnou vodivostí ze všech známých kovů. Slouží jako součást nejrůznějších slitin pro v elektronický průmysl, výrobu CD i DVD nosičů a šperkařství. Jeho sloučeniny jsou nezbytné i pro fotografický průmysl.
Zlato je odolný, velmi dobře tepelně i elektricky vodivý, ale poměrně měkký kov žluté barvy. Již od nepaměti byl používán pro výrobu dekorativních předmětů a šperků a posléze i jako měnová záruka při emisích bankovek. V současné době je navíc důležitým materiálem v elektronice, kde je ceněna jeho vynikající elektrická vodivost a odolnost proti korozi.
Obávaný chlór
Mezi prvky periodické soustavy je i řada těch, které mají zvláštní osobité vlastnosti. Často se v této souvislosti hovoří například o uranu. Pokud se totiž obohatí (zvýšení koncentrace izotopu 235U), je vhodný jako palivo pro jaderný reaktor, ale i k výrobě jaderné pumy.
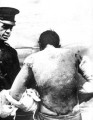
Vedle atomové bomby jsou však obávanou zbraní i jedovaté plyny, zejména světle zelený chlor. Ten je obsažen například i v Yperitu, prvním bojovém plynu, který byl nasazen v akci (Němci v 1. světové válce.). Chlor sice rád reaguje s jinými prvky, ale výsledné sloučeniny většinou nepatří k tomu, čím by se mohlo lidstvo chlubit. Například polychlorované bifenyly nebo dioxiny jsou krajně nebezpečné pro životní prostředí.
Použití yperitu v historii
Německo proti francouzským a anglickým jednotkám v roce 1917
Španělsko proti Maroku v letech 1923-1926
Itálie proti Etiopii v letech 1935-1940
Polsko proti Německu v roce 1939
Sovětský Svaz proti Číně v roce 1930
Japonsko proti Číně v letech 1937-1945
Egypt proti Severnímu Jemenu v letech 1963-1967
Irák proti Íránu v letech 1983-1988
Irák proti Kurdům v roce 1988
Střelný prach potřebuje síru
Ve vojenském průmyslu našel své využití i další prvek, síra. Číňané z ní totiž již od 7. století vyráběli nejstarší známou výbušninou na světě, střelný prach.
Vážným ekologickým problémem je však vzrůstající obsah oxidů síry v atmosféře. Je to důsledek lidské činnosti, především ve spojení s energetikou a vytápěním, neboť síra se v poměrně velkém množství vyskytuje v uhlí. Její oxidy pak reagují s vodní párou obsaženou ve vzduchu, čímž vznikají kyseliny (siřičitá a sírová). Ty se pak vracejí zpět na zem ve formě kyselých dešťů.
Prvky na naší planetě
Zemské jádro:
Železo 86,2%
Nikl 7,25%
Síra 5,96%
Kobalt 0,40%
Zemská kůra:
Kyslík 46,60%
Křemík 27,72%
Hliník 8,13%
Železo 5,00%
Vápník 3,63%
Dusík 2,83%
Draslík 2,59%
Mangan 2,09%
Atmosféra
Dusík 78,084%
Kyslík 20,946%
Argon 0,934%
CO2 0,035%
Neon 0,00182%
Helium 0,000524%
Metan 0,00017%
Krypton 0,00014%
Vodík 0,000055%
Převratný sen geniálního vědce
Legenda tvrdí, že periodická tabulka prvků vznikla kuriózním způsobem. Svému autorovi Dmitriji Ivanovičovi Mendělejevovi se měla zjevit ve snu. Jak to bylo ve skutečnosti?
Rusko 19. století nebylo bůhvíjak vyspělou zemí. Jedině hlavní město Petrohrad se mohlo vydávat za výkladní skříň carského státu, zbytek země byl zaostalý. Vždyť nevolnictví zde car Alexandr II. zrušil až v roce 1861 (v českých zemích bylo nevolnictví zrušeno v roce 1781, ale třeba otrokářství v USA bylo palčivým problémem ještě v druhé polovině 19. století.). Přesto ruská kultura dosáhla v 19. století velkého rozmachu. Jména jako Dostojevskij, Čechov nebo Puškin jsou dodnes známá po celém světě. Jenže na poli vědy to bylo poněkud horší…
Do této doby přišel v roce 1834 v Tobolsku v západní Sibiři na svět Dmitrij Mendělejev.
Během 19. století byl téměř každé dva roky objeven nový chemický prvek. Chemie se drala do popředí zájmu veřejnosti. I Mendělejeva toto nadšení zasáhlo a chemie se mu měla stát osudem.
Temperamentní student
Mendělejev již během studií prokázal bystrost, talent i vysokou inteligenci. To mu otevřelo cestu ke studiu v zahraničí. Nejprve pobýval v Paříži, kde studoval u experimentátora Henriho Regnaulta, jenž mimo jiné prokázal, že hodnota absolutní nuly činí –273 stupňů Celsia. Mendělejev později vyměnil Paříž za tehdejší evropskou vědeckou Mekku, německý Heidelberg.
Byl velmi temperamentní až výbušné povahy. Nezřídka se stávalo, že se se svými kolegy rozhádal, až zkumavky létaly přes celou laboratoř. Na druhou stranu měl schopnost nacházet podobnosti mezi zjevně neslučitelnými výsledky badání. Ve změtí zdánlivě banálních zjištění nacházel jakési základní principy. Například analýza rozpustnosti alkoholu ve vodě, což bylo téma jeho disertační práce, ho dovedla k důkladnějšímu studiu molekul a atomů.
Každý plyn má svou kritickou teplotu
První ovoce jeho výzkumů začalo přicházet. Mendělejev například objevil, že každý plyn má svou kritickou teplotu. Když se plyn zahřeje nad tuto teplotu, žádný tlak jej už nedokáže přeměnit zpět na kapalinu. Tento objev bývá sice přičítán irskému chemikovi Thomasi Andrewsovi, ten však k němu dospěl až dva roky po Mendělejevovi.
Talentovaný chemik měl špatných vlastností habaděj. Byl klasickým představitelem arogance vědy, která filosofii a umění označuje za nepotřebné. „V současnosti můžeme žít bez Platóna,“ tvrdil, „ale abychom odhalili tajemství přírody, bylo by zapotřebí alespoň dvou Newtonů.“
Rozlišení prvků musí přece existovat!
Když v roce 1869 začal Mendělejev psát knihu, která měla nést název Základy chemie, narazil ovšem hned na problém klasifikace prvků. První dvě kapitoly byly věnovány alkalickým prvkům a halogenům. Jenže co dál?
„Existuje další rozlišení chemických prvků, které mají podobné vlastnosti? Něco takového přece musí existovat! Prvky přece nemohou mít jen náhodné vlastnosti, to by bylo proti zákonům vědy!“ To vše se Mendělejevovi honilo hlavou, když po nocích seděl u svého pracovního stolu uprostřed ne zrovna uklizené pracovny. Začal tušit, že někde hluboko v problému je ukryta struktura, která přehledně ukáže společné vlastnosti prvků.
Vysněná tabulka
17. února 1869 se Mendělejev měl zúčastnit jakéhosi zasedání a dobu před odjezdem z Petrohradu si krátil tím, že na papír psal prvky, seřazené podle atomové hmotnosti. Po chvíli zbystřil! Zdálo se mu, že mezi některými prvky se objevuje zatím ne zcela určitý řád. Uvědomil si, že je nablízku velkého objevu!
Svou cestu okamžitě zrušil a horečně hledal způsoby, jak dojít ke svému cíli. Avšak vždy, když už se zdálo, že je blízko svého objevu, nějaký detail mu jeho práci zhatil. „V mojí hlavě se všechno skládá dohromady, ale já to nedokážu vyjádřit,“ naříkal vědec.
Vyčerpáním z namáhavého myšlení po chvíli usnul. „Ve snu jsem spatřil tabulku, ve které byly všechny prvky na správném místě. Když jsem se probudil, okamžitě jsem vše napsal na papír,“ řekl později Mendělejev. Prvky byly uspořádány podle své atomové hmotnosti a vlastnosti prvků se opakují v určitých periodách. Proto tedy periodická tabulka.
Některé prvky sice chyběly, ale i ty byly postupem času objeveny. A periodická tabulka prvků se neustále až do současnosti doplňuje, nyní výhradně o prvky, které vznikají v supermoderních laboratořích.
Objevy některých chemických prvků:
Starověk
Antimon
Bismut
Cín
Měď
Olovo
Rtuť
Síra
Stříbro
Uhlík
Zinek
Zlato
Železo
Středověk Arsen
1669 Fosfor
1738 Platina
1766 Vodík
1772 Dusík
1774 Chlor
Kyslík
1789 Uran
1807 Draslík
Sodík
1808 Vápník
1811 Jod
1823 Křemík
1825 Hliník
1868 Helium
1886 Fluor
1894 Argon
Jak se hledají nové prvky?
Kam až dosahují možnosti objevu nových prvků? Vědci pravidelně oznamují, že se jim v laboratořích podařilo vytvořit prvek, jehož protonové číslo je neskutečně vysoké. Naposledy se to podařilo společnému týmu amerických a ruských odborníků vloni.
Na podzim loňského roku měl společný americko-ruský vědecký tým pracující v laboratořích Spojeného ústavu jaderných výzkumů v Dubně u Moskvy pěkný důvod k oslavě. Podařilo se jim vytvořit zatím nejtěžší chemický prvek. Jeho protonové číslo dosáhlo úctyhodných 118. Na počest místa vzniku získal tento nový prvek jméno Moscovium.
Čtyřměsíční bombardování
Tak těžký prvek ovšem nevzniká snadno. Jeho zrod proběhl v urychlovači částic vytrvalým bombardováním kalifornia (protonové číslo 98) ionty vápníku. Experimenty trvaly 3 000 hodin, což odpovídá 125 dnům, a za celou tuto dobu se Moscovium objevilo celkem třikrát. Vždy v exempláři jediného atomu.
Tak těžký prvek je samozřejmě velmi nestabilní. Existence Moscovia v laboratorních podmínkách trvalo jen devět desetitisícin vteřiny (pro srovnání, doba trvání blesku na obloze se pohybuje v řádech setin vteřiny). Poté došlo k jeho rozpadu na prvek, který měl ve svém jádru 116 protonů.
Existuje vůbec?
Vše má ale malý háček. Ověřit možnou existenci tak těžkého prvku je velice složité. Ostatně, prvek s protonovým číslem 118 zatím nelze najít v Mendělejevově periodické tabulce prvků. Před zařazením musí totiž být jeho existence zcela věrohodně prokázána.
Mimochodem, periodická tabulka byla naposledy doplněna v roce 2004. Tehdy byl na ní zařazen prvek s názvem roetgenium (Rg). Ten měl atomové číslo 111 a objevili ho němečtí vědci již v roce 1994. Trvalo tedy dlouhých 10 let, než ho vědecká obec skutečně uznala.
To, že existuje prvek 118 už před sedmi lety oznámil ruský vědec Viktor Ninov. Postup, který Ninov popsal, a kterým měl prvek vzniknout však nikdo nedokázal uskutečnit. Laboratoře, ve kterých Ninov pracoval, později svůj objev odvolaly a samotný vědec dostal vyhazov.
Proč hledat nové prvky?
Prvek, který vydrží pohromadě devět desetitisícin vteřiny asi jen těžko najde praktické uplatnění. Přesto vědcům objevování nových prvků nedá spát. Proč? Když se novináři ptali Edmunda Hillaryho proč lezl na Mt. Everest, odpověděl lakonicky: „Protože je!“. Vědci by na otázku proč hledají nové prvky zřejmě odpověděli podobně: „Protože je to možné!“.
První uměle vytvořený transuran, tedy prvek, který se v periodické tabulce nachází za uranem (číslo 92), vznikl již v roce 1940. Tehdy v amerických laboratořích nechali vědci uran 238 bombardovat jádry těžkého vodíku (deuterony).
Celých pět prvků objevil nebo se na jejich objevu podílel jediný vědec, americký chemik Glenn Seaborg (1912 – 1999). Za objevy transuranů získal spolu s Edwinem Mattisonem McMillanem roku 1951 Nobelovu cenu (byl objevitelem všech transuranů až do čísla 102).
Tajemství transuranů
Jak už název transuran napovídá, jsou tyto prvky silně radioaktivní. Lehčí transurany lze najít například v jaderných reaktorech. Patří mezi ně neptunium (93), plutonium (94), americium (95) nebo curium (96). Ty lze zkoumat snadno, protože je lze „vytáhnout“ z vyhořelého jaderného paliva.
Zkoumat chemické vlastnosti těžkých transuranů je však krajně obtížné, vždyť nejdelší poločas rozpadu ze známých transuranů má seaborgium (106). Seaborgium vydrží pohromadě 21 sekund, u jiných jsou chemici rádi, když vydrží alespoň jedinou sekundu.
Jak vyrobit supertěžký prvek?
Pro výrobu těžkých transuranů je nutné vysoce citlivé experimentální zařízení. Ono totiž najít vzniklý atom supertěžkého transuranu není žádná legrace. Výzkum nejtěžších transuranů proto v současné době probíhá především v laboratořích v Dubně u Moskvy a v kalifornském Berkeley.
Urychlovač vysílá svazek vysokoenergetických iontů směrem k terčovému kotouči. Tento kotouč je obvykle vyroben z těžkého kovu, nejčastěji se používá olovo a bismut. Nezanedbatelná energie, který s sebou svazek přináší, se mění v teplo, takže kotouč se musí velmi rychlé otáčet, aby se neroztavil.
Při výrobě supertěžkých prvků je nutný rychlostní separátor. Ten podle předem daných výpočtů pozná, jakou rychlostí se transuran pohybuje. Protože v kotouči probíhá velké množství jaderných reakcí, jen díky separátoru se pak podaří případný nový prvek najít.
Poté, co částice jsou separovány, je „hlušina“ vstřebána v pohlcovači a potřebné atomy dopadnou směrem ke křemíkovým detektorům. Ty zaznamenají nejen jejich pozice, ale i energii a rozpadové řetězce.
Kde berou prvky jméno?
Prvky jsou často pojmenovávány po významných vědcích, kteří se svými objevy zasloužili o rozvoj jaderné fyziky, anebo podle místa, kde se je podařilo poprvé syntetizovat. Platí proto nepsané pravidlo, že jméno prvku si může navrhnout jeho objevitel. Organizace IUPAC ((International Union of Applied Chemists), která dohlíží nad nomenklaturou nově objevených prvků, pak musí prověřit zda prvek skutečně vznikl a schválit hlasy svých členů navržené jméno.
Slovníček základních pojmů
Absorpce – pohlcování plynů nebo par kapalinou nebo tuhou látkou, přičemž nedochází k chemické reakci (nevzniká nová látka)
Amfoterní prvky – prvky mající schopnost tvořit soli
Binární sloučeniny – sloučeniny, jejichž molekuly se skládají z atomů dvou prvků, například oxidy, sulfidy
Elektrolyt – roztok které vede elektrický proud
Elektronegativita – schopnost atomů přitahovat vazebné elektrony
Heterocyklické sloučeniny – organické látky, jejichž molekuly obsahují v uzavřeném řetězci kromě uhlíkových atomů též jeden nebo více jiných atomů, a to nejčastěji atomy dusíku, kyslíku a síry.
Hydroxidotvorný prvek – prvek, který tvoří hydroxid (kromě vodíku a kyslíku)
Chemická sloučenina – látka vzniklá sloučením dvou nebo více prvků
Chemický prvek – látka tvořená z atomů, které mají stejné protonové číslo
Indikátor – látka, která mění svou barvu v přítomností určitých iontů nebo jiných látek. Například, lakmus má červenou barvu v roztoku kyselém a modrou v roztoku zásaditém.
Ionty – částice nesoucí elektrický náboj. Ztrátou jednoho nebo více elektronů vznikají kladně nabité kationty, přijetím elektronů vznikají záporně nabité anionty.
Izotopy – atomy stejného prvku (mají stejný počet protonů a elektronů), které se liší počtem neutronů
Katalyzátor – je látka, která ovlivňuje rychlost chemické reakce, ale sama po skončení reakce se nezmění
Kyselinotvorný prvek – prvek, který tvoři kyselinu (kromě vodíku a kyslíku).
Makromolekula – velká molekula látky (molekula o velké hmotnosti). V makromolekulách je vázáno několik set až tisíc atomů
Makromolekulární látka – látka obsahující makromolekuly (příkladem makromolekulárních látek jsou plasty)
Molekula – částice tvořena dvěma nebo více atomy spojenými chemickou vazbou
Nukleon – společný název protonů a neutronů
Nukleonové číslo – celkový počet nukleonů, tj. protonů a neutronů, v atomovém jádře
Oxidační číslo – zdánlivý náboj, který by měly jednotlivé atomy ve sloučenině, jestliže by vazebné elektrony patřily prvku s větší elektronegativitou (viz)
Oxidotvorný prvek – prvek, který tvoří oxidy
Peroxid – sloučenina, u které mezi atomy kyslíků je vazba, například peroxid vodíku H-O-O-H.
Periodický zákon – chemické vlastnosti prvků se periodicky mění v závislosti na vzrůstajícím protonovém čísle.
Polární molekula – molekula, v které lze rozlišit dva póly – nabité kladně a záporně.
Radioaktivita – je vlastnost některých prvků vyzařovat z jádra svých atomů elementární částice.
Co způsobují chemické prvky v lidském těle?
Jsou prvky, bez kterých by život na naší planetě nebyl možný. Naopak jiné chemické elementy si se životem a zdravím příliš nerozumějí.
Nejen kyslíkem je lidský organismus živ. Pro zdravý vývoj jedince je důležité, aby se v jeho organismu vyskytovalo mnoho dalších prvků v určité rovnováze. Třeba takový vápník. Kostem a svalovým tkáním jeho nedostatek rozhodně nedělá dobře. Vápník pomáhá odstraňovat i svalové křeče, reguluje činnost srdce a přenos nervových impulsů.
Metlou starších lidí je v současnosti Alzheimerova nemoc. Podle některých výzkumů je více než pravděpodobné, že hliník by její rozvoj mohl brzdit. Ale s hliníkem opatrně, na druhou stranu jeho metalická forma totiž způsobuje rychlejší stárnutí mozku.
Na rakovinu je vanad
Klíčovým prvkem pro práci srdce je hořčík. Stejně důležitý je tento prvek i pro činnost enzymů. Zároveň udržuje elektrický potenciál mezi nervy a svalovými membránami a rovněž vyrovnává hodnotu pH vnitřního prostředí.
Pokud je v organismu nedostatek vanadu a chromu, dostaví se nutkavá chuť na sladké. V krvi je totiž nízký obsah cukru a pokud tento stav trvá příliš dlouho, může se rozvinout cukrovka. Chrom totiž hraje nezastupitelnou úlohu při přeměně glukózy na energii. Vanad zas ovlivňuje tukový metabolismus. Ale nejen to, dokáže zabraňovat onemocněním srdce a dokonce i rakovině.
Pro zdraví je ovšem důležitý i pravidelný přísun mědi. Její nedostatek se podepíše už na visáži. Pokožka není elastická, objevují se hluboké vrásky a šediny. Ještě horším důsledkem chybějící mědi je snížená produkce červených krvinek a s tím související chudokrevnost (anémie). Trpí i cévy, které se zeslabují.
Pokud mužům z ničeho nic začnou padat vlasy, je docela možné, že jim v těle schází cín. Ten právě příznivě ovlivňuje růst vlasů, ale hlavně zlepšuje činnost imunitního systému.
Prvek bor je důležitý pro produkci hormonů, u žen estrogenu a u mužů testosteronu. Pro ženy je významný i v čase menopauzy.
Bez zinku není sex
První známkou nedostatku zinku je ztráta chuti a čichu. Zinek má za úkol udržovat zdravý cévní systém, dohlíží i na správný vývoj pohlavních orgánů. Fosfor dodává organismu sílu a energii. Vedle vápníku i on sehrává podstatnou roli ve vývoji kostí.
Křemík má pozitivní vliv na vazivo, kůži, vlasy a urychluje hojení ran. Železo je důležité pro živé organismy tím, že je zastoupeno v hemoglobinu, který hraje klíčovou roli v transportu kyslíku z plic do tělesných tkání.
Podobně jako vanad nebo zinek, i selén je účinný v prevenci před zhoubným bujením buněk. Sodík zas reguluje hladinu tělesných tekutin. Kromě toho je důležitý i pro přenos nervových impulzů, podobně jako draslík. Ovšem přílišný nadbytek sodíků může vést k otokům.
Oblíbený nástroj travičů
Ovšem, ne všechny prvky mají na živé organismy pozitivní vliv. Předávkovat se lze i hliníkem, který přitom není toxický. Pokud se tak stane, postižený trpí poruchami řeči.
Relativně časté jsou otravy thaliem. Při velkých dávkách nastává delirium, křeče, hluboké bezvědomí a smrt, při menších dávkách vyvolává zvracení a krvavé průjmy, častým příznakem otravy je i vypadávání vlasů.
Oblíbeným nástrojem travičů býval arsen. Ten sám o sobě není jedovatý, ale v organismu je metabolizován na toxické látky, nejčastěji na oxid arsenitý. Akutní otravy se projevují zvracením, průjmy, svalovými křečemi, ochrnutím a nakonec zástavou srdce. Arsen způsobuje hyperpigmentaci kůže, keratózu (nadměrné rohovatění kůže) a další onemocnění včetně nádorů jater. Chronické vystavení arsenu způsobuje spontánní potraty, porody mrtvých dětí, předčasné porody, sníženou porodní váhu, mentální retardaci a systémová poškození orgánů.
Kdy hrozí olovo?
Již od starověku jsou známy otravy olovem. Taková otrava může mít za následek bolesti hlavy, únavu, potíže se soustředěním a další vážné zdravotní problémy. Podle posledních výzkumů, otrávilo olovo i jednoho z největších hudebních géniů Ludwiga van Beethovena. V době jeho života byla totiž vodovodní potrubí častokrát právě z olova. V dnešní době olovo stále hrozí, zejména v podobě jeho sloučenin.
Pro lidskou pokožku jsou nebezpečné i halogenové prvky. Fluor, chlor, brom i jod dokáží způsobit poleptání kůže. Například fluor na pokožku působí podobně jako plamen. Negativní účinky na kůži má i rtuť a fosfor. Ostatně, fosforové pumy byly použity už za 2. světové války. Vedle toho se otrava rtutí může projevit zvýšeným sliněním, červenáním dásní, uvolňováním zubů a nervovými poruchami. Rtuť se kdysi podávala jako lék lidem, kteří trpěli syfilitidou, na což doplatil třeba rakouský hudební skladatel Franz Schubert.
Významným toxickým prvkem je i kadmium. To narušuje fungování enzymů. Už několik gramů může usmrtit člověka. Dráždí dýchací cesty, funguje jako karcinogen a způsobuje neplodnost. Karcinogenem je i uran, který poškozuje ledviny, játra a některá životně důležitá centra.